A diario nos encontramos diversas sustancias comunes que se emplean con fines domésticos: el vinagre, el café, los jabones, los detergentes, los limpiadores, la sosa cáustica, las aspirinas, los antiácidos y la vitamina C.
Posiblemente has probado el vinagre que tiene un sabor agrio; sin embargo, quizá sepas que cuando se deja caer un trozo de mármol en una disolución de vinagre se desprende Dióxido de carbono conforme se disuelve, o bien que cuando se coloca en vinagre un pedazo de zinc, previamente lijado, se disuelve lentamente acompañado de un desprendimiento de hidrógeno gaseoso.
El vinagre es una disolución acuosa de ácido acético. Desde hace siglos, los químicos definieron los ácidos y las bases según las propiedades de sus disoluciones acuosas: así:
- Un ácido es una sustancia cuya disolución acuosa posee un sabor agrio (del latín acidus), tiñe de rojo el papel tornasol azul, reacciona con los metales activos desprendiendo Hidrógeno y neutraliza las bases.
- Una base es la sustancia cuya disolución acuosa posee un sabor amargo, tiñe de azul el papel tornasol rojo, tiene aspecto jabonoso y neutraliza los ácidos.
- Una base es la sustancia cuya disolución acuosa posee un sabor amargo, tiñe de azul el papel tornasol rojo, tiene aspecto jabonoso y neutraliza los ácidos.
Un ácido, al reaccionar con una base o viceversa, se neutraliza, y se obtiene como resultado una sal y agua.
Los ácidos, las bases y las sales se encuentran en la mayoría de las sustancias que interactúan contigo. Estas sustancias, al disolverse con agua, forman parte de compuestos clave para los sistemas biológicos.
 |
LOS ÁCIDOS Y LAS BASESÁCIDOS |
- En el estómago es muy importante el jugo gástrico que contiene ácido clorhídrico.
- Cuando realizas ejercicio físico por cierto tiempo, te duelen los músculos por el ácido láctico que se acumula en ellos.
- El electrólito de las baterías de los automóviles contiene ácido sulfúrico.
BASES😉
- La sosa o hidróxido de sodio se utiliza para fabricar los jabones.
- Leche de Magnesia para combatir la acidez estomacal o como laxante.
 De las sustancias que forman parte de nuestra cotidianidad unas se muestran con carácter ácido y otros de carácter básico. A nivel industrial también el nivel de acidez o basicidad de las sustancias son primordiales.
De las sustancias que forman parte de nuestra cotidianidad unas se muestran con carácter ácido y otros de carácter básico. A nivel industrial también el nivel de acidez o basicidad de las sustancias son primordiales.
¿Cómo determinar el nivel de acidez y basicidad de cada una de ellas?
 |
| La respuesta está en el pH. |
El pH es una variable química que nos permite medir el grado de acidez de una sustancia. Su definición tiene cierta complejidad y aún así ha calado en el lenguaje coloquial. Sin embargo, la palabra pH no siempre se emplea de manera correcta.
De hecho, ignorar el significado del pH hace que las decisiones también sean ignorantes.
Para entender ¿Qué es el pH? primero debemos entender:
¿Qué es un ácido?
Al principio hablábamos de ácidos como sustancias con una serie de propiedades comunes con respecto al sabor ácido del limón o del vinagre, estos sabores dependen del ácido cítrico y del ácido acético, respectivamente.
Los álcalis del árabe alkali que significa cenizas vegetales son opuestos a los ácidos, y producen sensación jabonosa en la piel y tiñen de azul el tornasol.
Cuando mezclamos una sustancia ácida con otra alcalina se obtiene una sal que pierde las propiedades de ambas.
A partir de la definición de ácido de Brönsted y Lowry, el químico Søren Peter Lauritz Sørensen introdujo por primera vez en 1909 el concepto de pH. El pH está ligado a la cantidad de H+, entonces:
¿Qué es pH?
El pH indica la concentración de iones de Hidrógeno presentes en determinadas disoluciones. La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
Para darle una numeración más manejable, Sørensen decidió aplicar la función logaritmo sobre el valor de la concentración de H+.
Esa es la definición matemática del pH: el logaritmo en base 10, cambiado de signo, de la concentración de H+, cuando ésta se expresa en moles por decímetro cúbico.
De esa manera obtuvo una escala de pH, que oscila entre los valores 0 y 14. Así, el valor de:
- pH 7 se corresponde con las sustancias neutras. El agua pura tiene pH 7.
- Las sustancias ácidas son las que tienen un pH inferior a 7,
- Las sustancias básicas tienen pH superior a 7.
En la actualidad, para medir el pH utilizamos un electrodo sensible a los H+. Se conoce como pH-metro (pronunciado peachímetro). Cada vez que se usa hay que calibrarlo usando unas disoluciones de referencia cuyo pH es conocido y sirven de patrón para que el aparato construya la escala de pH.
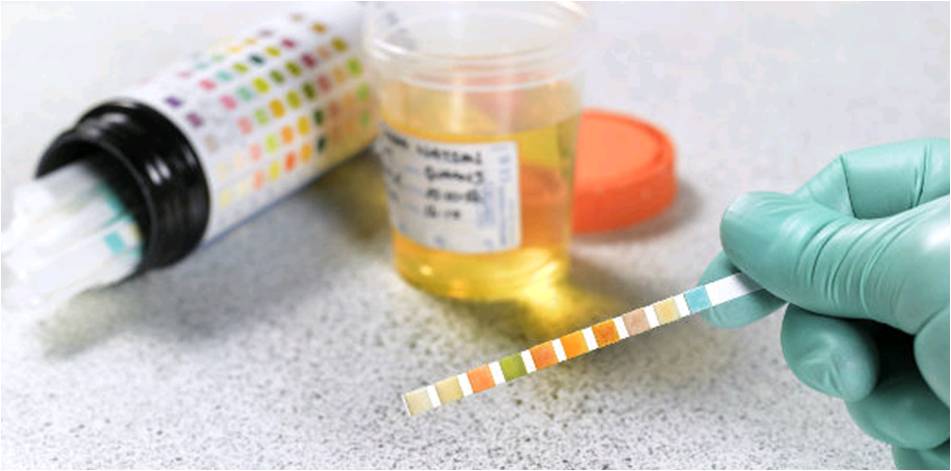
Hay otras maneras de medir el pH. Una manera no tan precisa, pero útil, es el uso de indicadores colorimétricos de pH. Según el color que adquieren, podemos saber el valor aproximado del pH. Es muy utilizado en los análisis de orina para identicar cambio de pH tal vez por la presencia bacteriana.
Observa la siguiente imagen en la que se identifica varios ejemplos de nuestra vida cotidiana y su presencia en la escala de pH.